Nota técnica 02/2021
Ensaios Clínicos: orientações para indexação de acordo com a Metodologia LILACS
| Objetivo: Orientar a análise e leitura técnica dos documentos para identificar “ensaio clínico”, “protocolo de ensaio clínico”, “ensaio clínico controlado”, “ensaio clínico controlado aleatório”, “ensaio clínico fase I”, “ensaio clínico fase II”, “ensaio clínico fase III” e “ensaio clínico fase IV”, seja como tipo de publicação ou descritor de assunto. | |
| Público-alvo: Profissionais da informação que atuam na indexação de documentos usando a Metodologia LILACS ou na elaboração de estratégias de busca na LILACS e nas Bibliotecas Virtuais em Saúde (BVS). | |
| Conteúdo: Metodológico | Data de criação: julho 2021 |
Introdução
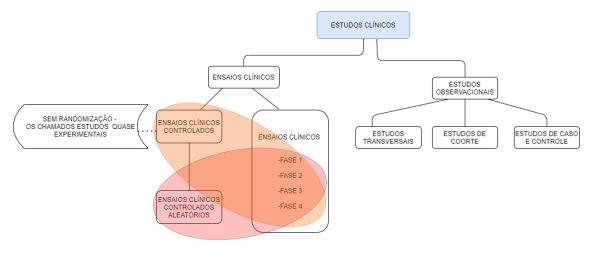
Os estudos clínicos são caracterizados por pesquisas que envolvem humanos. Há dois tipos de estudos clínicos: ensaios clínicos (também chamados de estudos intervencionais) e os estudos observacionais.1
Ensaios clínicos: os participantes recebem algum tipo de intervenção para tratamento, prevenção, diagnóstico ou procedimento. Geralmente incluem: drogas experimentais, células ou outros produtos biológicos, vacinas, dispositivos médicos, procedimentos cirúrgicos ou outros tratamentos médicos, terapia comportamental ou psicoterapia, alterações em serviços de saúde, estratégias de prevenção em saúde e intervenções educacionais em saúde.2
Estudos observacionais: também avaliam resultados de saúde em grupos de participantes de acordo com um plano ou protocolo. Os participantes não foram selecionados para uma intervenção específica ou com intenção de teste pelo pesquisador. Por exemplo, os pesquisadores podem observar em um grupo de idosos o impacto de diferentes estilos de vida na saúde cardíaca dos indivíduos.1 Os estudos observacionais são ótimas bases para o entendimento de doenças. Porém, nesses estudos a alocação nos grupos baseados no fator de risco não pode ser controlada pelo pesquisador.
Principais características de um ensaio clínico:3
– Envolver humanos na pesquisa;
– Ser um estudo prospectivo;
– Avaliar os efeitos de uma intervenção nos participantes;
– Avaliar o resultado da intervenção em relação ao aspecto biomédico/comportamental e qualidade de vida em saúde, etc.
Entendendo os ensaios clínicos para fins de indexação
É importante destacar que podemos encontrar na literatura variações de classificação e conceitos dos ensaios clínicos. E ainda, é mais comum que a classificação dada pelo autor do estudo à sua própria pesquisa não preencha claramente os critérios estabelecidos para aquela fase determinada.
No contexto da indexação e limitando-se aos descritores disponíveis no DeCS/MeSH, podemos conceituar os principais tipos de ensaios clínicos: 1,2-4,5
Ensaio clínico: Estudo prospectivo comparando os efeitos e o valor de uma intervenção relacionada a um grupo controle, em que seus participantes são acompanhados por um período determinado. Classicamente, os ensaios clínicos para o desenvolvimento de drogas são divididos em 4 fases. Os estudos com outros tipos de intervenção, principalmente aqueles que envolvam alteração de comportamento ou estilo de vida ou procedimentos cirúrgicos, não são desenvolvidos em todas essas fases.
Ensaio clínico de fase I: Nesta fase são recrutados indivíduos, voluntários sadios ou doentes que falharam em terapias existentes. Nela procura-se descobrir ou estabelecer parâmetros para dosagem e segurança do medicamento, farmacocinética, farmacodinâmica, período de administração, efeitos colaterais e toxicidade. São avaliadas a tolerabilidade e a segurança da intervenção. O tamanho do grupo pode variar dependendo do tipo da pesquisa, compreendendo entre 20 a 100 voluntários.
Ensaio clínico de fase II: Nessa fase o grupo recrutado para a pesquisa é geralmente maior que aquele da fase I, compreendendo de 70 a 200 voluntários. Aqui passa-se para uma exploração do efeito terapêutico da intervenção e o grupo de avaliação é formado somente com voluntários doentes. São avaliadas as ações de farmacocinética e eficácia das drogas utilizadas, e se os resultados forem seguros e satisfatórios, o estudo passará para a fase III.
Ensaio clínico de fase III: Essa talvez seja a fase mais comum de se encontrar nos principais periódicos científicos. No ensaio clínico de fase III o grupo controle e randomização estão presentes na maior parte dos trabalhos. Os grupos são maiores que os grupos das fases anteriores, compreendendo centenas ou milhares de voluntários (300-3.000). O objetivo dessa fase é estabelecer a comprovação terapêutica e eficácia da intervenção testada, e. estabelecer valores mais precisos de taxas de reações adversas da intervenção. O desenho mais comum dos ensaios de fase III é o ensaio de eficácia comparativa com uma terapia padrão ou placebo.
Ensaio clínico de fase IV: Os ensaios clínicos de fase IV se caracterizam por estudos que acontecem após o medicamento/intervenção ter sido aprovado pela agência reguladora. Permitem acompanhar os efeitos da medicação a longo prazo e a identificação de ações adversas de início tardio e que não foram identificadas nas fases anteriores. Nesta fase, teoricamente, não existe mais grupo controle e randomização, no entanto muitos estudos são encontrados como ensaio clínico randomizado de fase IV.
Ensaio clínico controlado (ensaio clínico não randomizado/quase experimental): esse tipo de estudo envolve uma abordagem de seleção dos grupos sem randomização, ou seja, existe a separação dos participantes em grupo controle e grupo de intervenção, no entanto os participantes são alocados nos grupos por própria decisão ou por decisão do pesquisador.
Ensaio clínico controlado aleatório: Em alguns estudos de fase II e em todos os estudos de fase III os indivíduos são alocados em grupos para receberem diferentes intervenções. O processo de alocação dos indivíduos ao acaso chama-se randomização ou aleatorização. É exatamente esse processo de randomização que faz com os ensaios clínicos controlados aleatórios sejam considerados padrão ouro no estudo das intervenções. Isso se deve ao seu desenho que minimiza os fatores de confusão causados pelas informações dos indivíduos avaliados. Se bem delineados e conduzidos têm forte capacidade de criação de novos protocolos clínicos ou atualização de protocolos vigentes.
Características dos ENSAIOS CLÍNICOS FASE I
Oliveira RV Filho, Antunes NJ, Ilha JO, Moreno RA, Wedemeyer RS, Warnke A, et al. Pharmacokinetics and pharmacodynamics of three dosages of oestriol after continuous vaginal ring administration for 21 days in healthy, postmenopausal women. Br J Clin Pharmacol. 2019;85(3):551-62. https://doi.org/10.1111/bcp.13822

Características dos ENSAIOS CLÍNICOS FASE II
Lalla RV, Solé S, Becerra S, Carvajal C, Bettoli P, Letelier H, et al. Efficacy and safety of Dentoxol® in the prevention of radiation-induced oral mucositis in head and neck cancer patients (ESDOM): a randomized, multicenter, double-blind, placebo-controlled, phase II trial. Support Care Cancer. 2020;28(12):5871-9. https://doi.org/10.1007/s00520-020-05358-4

Características dos ENSAIOS CLÍNICOS FASE III
Viecca M, Radovanovic D, Forleo GB, Santus P. Enhanced platelet inhibition treatment improves hypoxemia in patients with severe Covid-19 and hypercoagulability: a case control, proof of concept study. Pharmacol Res. 2020;158:104950. https://doi.org/10.1016/j.phrs.2020.104950

Características dos ENSAIOS CLÍNICOS FASE IV
Marx G, Zacharowski K, Ichai C, Asehnoune K, Černý V, Dembinski R, et al. Efficacy and safety of early target-controlled plasma volume replacement with a balanced gelatine solution versus a balanced electrolyte solution in patients with severe sepsis/septic shock: study protocol, design, and rationale of a prospective, randomized, controlled, double-blind, multicentric, international clinical trial : GENIUS-Gelatine use in ICU and sepsis. Trials. 20212;22(1):376. https://doi.org/10.1186/s13063-021-05311-8

Características dos ENSAIOS CLÍNICOS CONTROLADOS (QUASE EXPERIMENTAIS)
Arkkukangas M, Bååthe KS, Ekholm A, Tonkonogi M. A 10-week judo-based exercise programme improves physical functions such as balance, strength and falling techniques in working age adults. BMC Public Health. 2021;21(1):744. https://doi.org/10.1186/s12889-021-10775-z

Harned MS, Schmidt SC, Korslund KE, Gallop RJ. Does Adding the Dialectical Behavior Therapy Prolonged Exposure (DBT PE) Protocol for PTSD to DBT Improve Outcomes in Public Mental Health Settings? A Pilot Nonrandomized Effectiveness Trial With Benchmarking. Behav Ther. 2021;52(3):639-55. https://doi.org/10.1016/j.beth.2020.08.003

Os descritores
As notas de escopo dos descritores DeCS/MeSH e o manual de indexação6 definem:
ENSAIO CLÍNICO [Tipo de publicação]
Estudos pré-planejados para os quais as observações a serem feitas devem ser planejadas. Aos participantes são atribuídas uma ou mais intervenções, de forma que os pesquisadores possam avaliar as intervenções nos desfechos biomédicos e naqueles relacionados à saúde.
ENSAIO CLÍNICO FASE I [Tipo de publicação]
Trabalho que relata um estudo clínico, pré-planejado, geralmente controlado, da segurança e eficácia de drogas de uso diagnóstico, terapêutico ou profilático e de dispositivos ou técnicas, baseado em um pequeno número de pessoas sadias e conduzido no período de aproximadamente um ano.
ENSAIO CLÍNICO FASE II [Tipo de publicação]
Trabalho que relata um estudo clínico, pré-planejado, geralmente controlado, da segurança e eficácia de drogas de uso diagnóstico, terapêutico ou profilático, e de dispositivos ou técnicas, baseado em várias centenas de voluntários, incluindo um número limitado de pacientes, e conduzido no período de aproximadamente dois anos.
ENSAIO CLÍNICO FASE III [Tipo de publicação]
Trabalho que relata um estudo clínico, pré-planejado, geralmente controlado, da segurança e eficácia de drogas de uso diagnóstico, terapêutico ou profilático, e de dispositivos ou técnicas após os ensaios clínicos fase II. Um grupo suficientemente grande de pacientes é estudado e estreitamente monitorado por médicos para resposta adversa à exposição prolongada, no período de aproximadamente três anos.
ENSAIO CLÍNICO FASE IV [Tipo de publicação]
Trabalho que relata um estudo pós-marketing planejado de drogas de uso diagnóstico, terapêutico ou profilático e de dispositivos ou técnicas já aprovados para venda após os ensaios clínicos fases I, II e III. Estes estudos frequentemente contêm dados adicionais sobre a segurança e a eficácia de um produto.
ENSAIO CLÍNICO CONTROLADO [Tipo de publicação]
Trabalho que relata um ensaio clínico envolvendo um ou mais tratamentos experimentais, pelo menos um tratamento controle, resultados determinados para avaliar a intervenção estudada, e um método não tendencioso para designar pacientes aos tratamentos experimentais. O tratamento pode ser com drogas, dispositivos, ou procedimentos estudados para eficácia diagnóstica, terapêutica ou profilática. Os métodos de controle incluem placebos, medicamento ativo, não tratamento, formas de dosagem e regimes, comparações de históricos clínicos, etc. Quando a distribuição aleatória for com técnicas matemáticas, como o uso de uma tábua de números aleatórios, é utilizada para designar pacientes para tratamentos experimentais ou de controle, o ensaio se caracteriza como sendo um ENSAIO CLÍNICO CONTROLADO ALEATÓRIO.
ENSAIO CLÍNICO CONTROLADO ALEATÓRIO [Tipo de publicação]
Trabalho que relata um ensaio clínico que envolve pelo menos um tratamento teste e um tratamento controle, de início e seguimento simultâneos dos grupos teste e controle, e nos quais os tratamentos a serem administrados são selecionados por processo aleatório, como o uso de uma tabela de números aleatórios.
PROTOCOLO DE ENSAIO CLÍNICO [Tipo de publicação]
Descrição escrita de um estudo clínico. Contém os objetivos, o desenho e os métodos de um estudo e/ou o critério de inclusão de voluntários no estudo. Também pode apresentar a base científica envolvida e informação estatística.
Na indexação
- O fato de um estudo conter o número de registo em bases de ensaios clínicos, como a ClinicalTrials.gov, não confere absoluta certeza que se trate de um ensaio clínico, já que estudos observacionais também são registrados nessas bases. Entretanto, essa informação vale a atenção do indexador na identificação correta do estudo.
- O CONSORT checklist (CONsolidated Standards Of Reporting Trials) é um documento que indica os itens essenciais que foram contemplados na elaboração do estudo. Muitas vezes o checklist CONSORT é citado no texto e pode servir como informação relevante para a indexação do documento.
- As fases dos ensaios clínicos (I, II, III e IV) muitas vezes não estão indicadas nos estudos. Só devem ser indexadas as fases dos estudos caso contenha essa informação no documento.
- A coordenação com ensaios clínicos controlados ou com ensaios clínicos controlados aleatórios pode ser feita com estudos em todas as fases, mesmo com estudos de fase IV, que teoricamente, e por definição, não precisa de grupo controle e randomização.
- Revisões ou revisões sistemáticas que utilizem os ensaios clínicos como base do estudo, deverão ser indexadas com os Descritores dos ensaios correspondentes como assunto.
- A coordenação com HUMANOS [Pré-codificado] é obrigatória. Devem ser indexados também os demais pré-codificados identificados no documento.
- Não é possível a coordenação com ESTUDO DE AVALIAÇÃO [Tipo de Publicação] e ESTUDO OBSERVACIONAL [Tipo de Publicação]. Esses são tipos de estudos excludentes.
- Os protocolos de ensaios clínicos deverão ser indexados com PROTOCOLO DE ENSAIO CLÍNICO [Tipo de Publicação]. Ex.: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8162287/
- Desenho, projeto, metodologia e os aspectos econômicos de protocolos de ensaios clínicos, deverão ser indexados como primário com PROTOCOLOS DE ENSAIO CLÍNICO COMO ASSUNTO e se possível, coordenar com o descritor de assunto do tipo de ensaio clínico correspondente.
Análise e indexação do documento:
- Verifique se o estudo trata de intervenção em humanos. Se for em animais considere avaliar se corresponde a ENSAIO CLÍNICO VETERINÁRIO [Tipo de Publicação].
- Tenha certeza de que o estudo seja prospectivo. Não existem ensaios clínicos com abordagem retrospectiva.
- Verifique se há comparação entre grupos – controle e de intervenção. Se houver, já se caracteriza como ENSAIO CLÍNICO CONTROLADO [Tipo de Publicação].
- Caso haja aleatorização para distribuição se caracteriza por um ENSAIO CLÍNICO CONTROLADO ALEATÓRIO [Tipo de Publicação].
- Indexe a fase do ensaio clínico se estiver indicada no documento.
ÁRVORE DE DECISÃO

Descritores e qualificadores relacionados
ESTUDO MULTICÊNTRICO [Tipo de Publicação]
Trabalho que relata um estudo executado por várias instituições cooperantes.Os estudos multicêntricos são estudos que ocorrem de forma simultânea por meio de um mesmo protocolo em diversas instituições.
ENSAIO CLÍNICO PRAGMÁTICO [Tipo de Publicação]
Estudos clínicos aleatórios que comparam intervenções em situações clínicas e que visualizam um espectro de possibilidades de desfechos e impactos.Os ensaios clínicos pragmáticos são estudos que objetivam mais na resolução de problemas de saúde do que entender mecanismos de ação. Os investigadores tem suas análises baseadas em pacientes encontrados sem sua rotina de atendimento.7 Caso o ensaio pragmático seja mencionado no documento, ele deve ser indexado.
DISTRIBUIÇÃO ALEATÓRIA [Descritor]
Processo envolvendo a probabilidade usada em ensaios terapêuticos ou outra investigação que tem como objetivo alocar sujeitos experimentais, humanos ou animais, entre os grupos de tratamento e controle, ou entre grupos de tratamento. Pode também ser aplicado em experimentos em objetos inanimados.
MÉTODO DUPLO-CEGO [Descritor]
Método de estudo sobre uma droga ou procedimento no qual ambos, grupos estudados e investigador, desconhecem quem está recebendo o fator em questão.Caso esse método seja mencionado no documento, ele deve ser indexado.
MÉTODO SIMPLES-CEGO [Descritor]
Método de estudo sobre uma droga ou procedimento no qual os grupos estudados desconhecem quem está recebendo o fator em questão, mas o investigador, sim.Caso esse método seja mencionado no documento, ele deve ser indexado.
PLACEBOS [Descritor]
Qualquer medicamento ou tratamento fictício. Embora originalmente os placebos sejam preparações medicinais sem atividade farmacológica específica contra uma condição alvo, o conceito foi estendido para incluir tratamentos ou procedimentos, especialmente aqueles administrados a grupos controle nos ensaios clínicos, visando obter medidas basais para o protocolo experimental.Indexar com esse descritor quando for particularmente discutido o uso placebo.
ESTUDOS CROSS-OVER [Descritor]
Estudos comparando dois ou mais tratamentos ou intervenções nos quais os sujeitos ou pacientes, após terminado o curso de um tratamento, são ligados a outro. No caso de dois tratamentos, A e B, metade dos sujeitos são randomicamente alocados para recebê-los pelo método A, B e metade para recebê-los pelo método B, A. Uma crítica deste desenho experimental é que os efeitos do primeiro tratamento podem ser transportados para o período quando o segundo é executado. Caso esteja claro no texto que se trata desse tipo de estudo, fazer a coordenação com o ensaio clínico correspondente.
Coordenações excludentes:
ESTUDO DE AVALIAÇÃO [Tipo de Publicação]
ESTUDO OBSERVACIONAL [Tipo de Publicação]
ESTUDO COMPARATIVO [Tipo de Publicação]
ESTUDOS RETROSPECTIVOS [Descritor]
Exemplo de indexação de documento
Leyva F, Guerrero E, Arcila D, Serralde A, Flores A, García M, et al . Association between stages of change regarding weight reduction in patients with cardiovascular risk factors: a randomized controlled trial. Rev Chil Nutr. 2021; 48 3):381-8. http://dx.doi.org/10.4067/s0717-75182021000300381

Referências
1 National Institute of Health. ClinicalTrials.gov. Learn about clinical studies [internet]. Bethesda: ClinicalTrials.gov; 2019 [cited 2021 July 1]. Available from: https://clinicaltrials.gov/ct2/about-studies/learn2
2 Australian Clinical Trials. What is a clinical trial? [internet]. Canberra: National Health and Medical Research Council; 2015 [cited 2021 July 1]. Available from: https://www.australianclinicaltrials.gov.au/what-clinical-trial
3 National Institute of Health. NIH Central Resource for Grants and Funding Information. Decision Tree for NIH Clinical Trial Definition [internet]. Bethesda: NIH Central Resource for Grants and Funding Information; 2019 [cited 2020 July 1]. Available from: https://grants.nih.gov/policy/clinical-trials/CT-decision-tree.pdf
4 Fridman LM, Furberg CD, DeMets DL, Reboussin DM, Granger CB. Fundamentals of clinical trials. 5th. Cham: Springer International Publishing; 2015.
5 Sociedade Brasileira de Profissionais em Pesquisa Clínica. Quais as fases de uma pesquisa clínica? [internet]. São Paulo: SBPPC; 2020 [cited 2021 July 2]. Available from: https://www.sbppc.org.br/fases-de-uma-pesquisa-clinica
6 BIREME. Biblioteca Virtual em Saúde. Manual de Indexação de Documentos para a Base de Dados LILACS (2021) [Internet]. São Paulo: BIREME; 2021 [cited 2021 June 8]. Available from: https://lilacs.bvsalud.org/metodologia-lilacs/manual-de-indexacao-de-documentos-para-a-base-de-dados-lilacs/
7 Coutinho ES, Huf G, Bloch KV. Ensaios clínicos pragmáticos: uma opção na construção de evidências em saúde. Cad Saude Pública. 2003;19(4):1189-93. Available from: https://doi.org/10.1590/S0102-311X2003000400039

Este obra está licenciado com uma Licença Creative Commons Atribuição-NãoComercial-CompartilhaIgual 4.0 Internacional.

